Онкологические заболевания в последние годы выходят на первое место среди причин смерти в развитых странах. При этом, несмотря на появление новых методов диагностики и лечения, справиться с раком до сих очень сложно. Почти все известные способы борьбы с опухолью имеют значительные побочные эффекты и бывают бесполезны против устойчивых раковых клеток. Решить проблему может фототермическая терапия и ее комбинации с другими методами лечения злокачественных новообразований. Ученые ИТМО разработали новых подход к терапии меланомы с использованием золотых наночастиц, который позволит бороться с опухолью более эффективно и безопасно. О сути исследования и его перспективах рассказываем в материале.

Демонстрация измерения времени жизни флуоресценции родамина, которым прокрашены клетки меланомы, ассоциированные с золотыми наночастицами. Фото: Дмитрий Григорьев / ITMO.NEWS
За одной решенной проблемой приходит другая: онкология в мире
Сердечно-сосудистые заболевания долгое время лидировали среди причин смерти во всем мире. Однако сейчас на первое место во многих развитых странах выходят онкологические заболевания. Например, в России, по данным Минздрава, ежегодно диагностируют около 10 000 новых случаев заболеваний меланомой — раком кожи. Это одна из сложнейших форм злокачественных опухолей: она быстро метастазирует и ее сложно обнаружить.
На ранних стадиях меланому лечат хирургически, а на поздних — химиотерапией. Но у этих подходов есть ряд недостатков, из-за которых лечение не всегда бывает успешным. Поэтому сейчас перед учеными стоит важная задача — найти более качественный, универсальный и безопасный метод лечения.
Вводим, светим, греем: возможное решение
Один из претендентов на это звание — фототермическая терапия. Ее суть ― использовать молекулы или наночастицы, которые бы накапливались в зоне опухоли и нагревались под воздействием лазера. В этом случае, облучая опухоль, можно создать локальный перегрев клеток, что приведет к их гибели.
У метода есть три важных преимущества. Во-первых, у раковых клеток нет механизмов для защиты от перегрева, то есть они не смогут выработать устойчивость к фототермической терапии. Во-вторых, в процессе лечения можно выбирать, на какие ткани воздействовать, и это увеличивает селективность. В-третьих, гибель клеток вследствие такого перегрева приводит к активизации иммунитета, что повышает эффективность лечения.
При этом доставить наночастицы к месту назначения можно двумя способами: прямой инъекцией или через кровоток. Дело в том, что злокачественная опухоль — это неструктурированная масса активно делящихся клеток, она требует большого количества кислорода и питательных веществ и потому активно кровоснабжается. Однако опухолевые клетки делятся намного быстрее, чем успевают формироваться новые сосуды. Это приводит к большому количеству отверстий в стенках капилляров, в которых застревают наночастицы. Благодаря этому они накапливаются в зоне опухоли.
Нет худа без добра: клетки сами выбирают, как им умирать
Несмотря на перспективность фототермической терапии, и у нее есть ряд проблем. Например, гибель клеток при разных температурах может идти по двум сценариям: облучение либо создает такие условия, что клетка сама решает «умереть» (апоптоз), либо повреждает клетку так, что она не способна больше существовать (некроз). В итоге, опухолевая клетка все равно умирает, но тип ее гибели влияет на эффективность лечения. Например, при некрозе возникает воспаление, которое становится дополнительной нагрузкой на организм ― при этом улучшается кровоснабжение, из-за чего остатки опухоли могут расти еще быстрее.
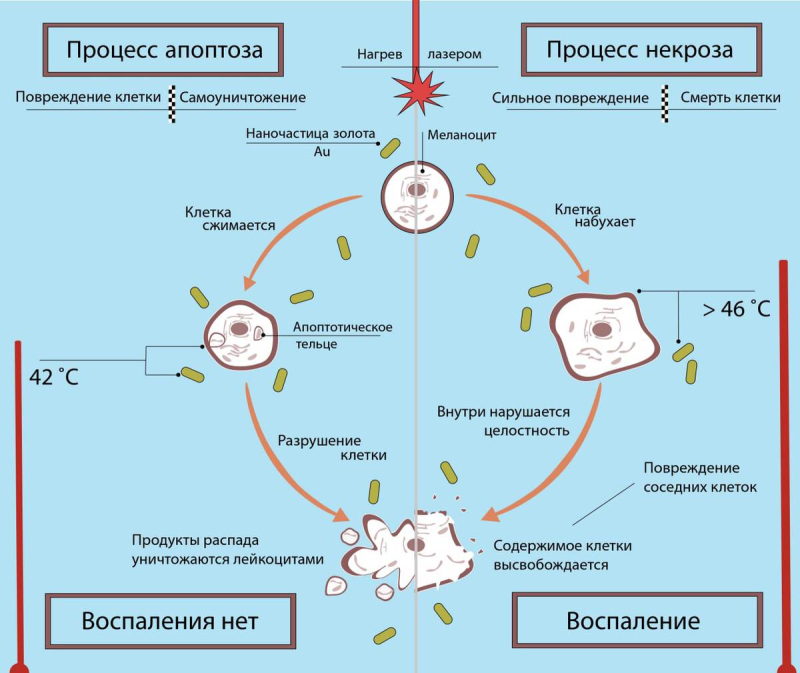
Процессы, происходящие при разных типах гибели клеток. Инфографика: Дарья Боголюбова / ITMO.NEWS
Поэтому во время фототермической терапии необходимо контролировать тип клеточной гибели, а значит, нужно определить, при каких температурах нагрева клетка выбирает тот или иной сценарий. И тут возникает новая проблема. Дело в том, что температуру тканей достаточно легко измерить, например, с помощью тепловизора — прибора, фиксирующего инфракрасное излучение от тел, нагретых выше -50 °С. Однако температура тканей не равна температуре содержащихся в ней клеток. Поэтому для оценки эффективности фототермический терапии важно знать не только значение температуры в определенной точке, но и ее распределение внутри клетки.
Теперь еще и красим: что предлагают ученые
Решением этой проблемы занимаются ученые ИТМО. Под руководством аспиранта и младшего сотрудника Нового физтеха Алексея Пельтека они разработали собственную методику измерения внутриклеточной температуры. Секрет подхода в использовании особых молекул — флуорофоров.
При облучении определенной длиной волны эти соединения возбуждаются и начинают светиться. Продолжительность этого свечения — или, как его называют ученые, время жизни флуоресценции — зависит от разных факторов окружающей среды, в том числе температуры. Таким образом, если покрасить клетку флуоресцентным красителем, при нагреве можно измерить время жизни флуоресценции и, как следствие, рассчитать внутриклеточное распределение температур.

Команда исследователей Нового физтеха ИТМО, которые работали над проектом (слева направо): инженер Владислав Ридош, аспирант и младший научный сотрудник Алексей Пельтек, аспирант Константин Арабули, аспирантка и инженер Диана Гагаринова, аспирантка и инженер Лидия Михайлова, аспирантка и инженер Елена Герасимова, аспирантка и инженер Мария Тимофеева, инженер Анатолий Отрощенко. Фото: Дмитрий Григорьев / ITMO.NEWS
Когда пора остановить нагрев: проверка гипотезы
Для проверки своей гипотезы ученые использовали золотые наночастицы и лазер с длиной волны 1064 нм (ближняя инфракрасная область). Параметры лазера были выбраны так, чтобы его луч проник сквозь ткани и достиг опухоли — а сделать это можно только в той области спектра, волны которой меньше всего взаимодействуют с клетками человека. В качестве экспериментального объекта ученые выбрали клетки меланомы мышей — эта опухоль находится на «поверхности» тела, и потому на нее проще воздействовать лазером.
«В работе нам нужны были частицы, которые бы поглощали в диапазоне “окна прозрачности” тканей. Под эти параметры подходит большое количество наночастиц, однако золотые частицы не взаимодействуют с тканями и очень хорошо поглощают при длине волны около 1000 нм, что позволило нам использовать меньшее количество частиц для достижения необходимого уровня нагрева. К тому же золотые наночастицы — классический объект фототермической терапии. Мы делали упор на разработку и демонстрацию нового метода измерения температуры и потому хотели взять в качестве материала что-то известное и хорошо изученное. Так мы бы могли удостовериться, что наш метод работает и результаты, которые мы получаем, совпадают с результатами, полученными до нас», — объясняет первый автор статьи, аспирант и младший научный сотрудник Нового физтеха ИТМО Алексей Пельтек.
В работе с клеточными линиями исследователям ИТМО помогали коллеги из Первого Санкт-Петербургского государственного медицинского университета им. И.П. Павлова. Благодаря совместным усилиям удалось выяснить, что нагрев клеток до 42 °С приводит к апоптозу, а дальнейшее повышение температуры выше 46 °С ― к некрозу. Вычислить эти границы нужно было, чтобы найти оптимальные условия для фототермической терапии и приступить к следующему шагу — доклиническим испытаниям на животных.
Нет предела совершенству: доклинические испытания
Разработав методику и найдя оптимальные температуры для терапии, ученые опубликовали статью в престижном научном журнале Nanophotonics, но на этом работа не остановилась. На данный момент исследователи уже закончили доклинические испытания на лабораторных мышах: провели им фототермическую терапию с помощью золотых наночастиц и попытались достичь оптимальных температур нагрева — чтобы вызвать апоптоз опухолевых клеток. Сейчас исследователи готовят новую научную статью: в ней они сравнивают комбинации разных способов борьбы со злокачественными новообразованиями.
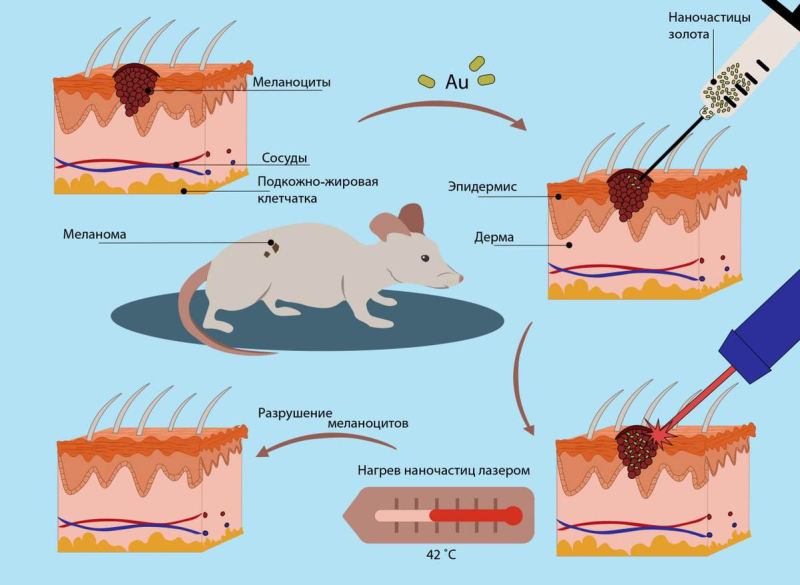
Схема работы фототермической терапии на примере лабораторной мыши с меланомой. Инфографика: Дарья Боголюбова / ITMO.NEWS
В экспериментах на мышах также не обошлось без коллабораций. Так, сотрудники вивария Санкт-Петербургского химико-фармацевтического университета помогали с выведением и содержанием лабораторных мышей, часть которых затем проходила курс радионуклидного лечения в Российском научном центре радиологии и хирургических технологий имени А.М. Гранова.
Одна терапия хорошо, а две лучше: практическое применение
В своей второй работе ученые сосредоточились на исследовании комбинаций фототермической терапии с другими методами лечения рака: радионуклидным и химиотерапией. Дело в том, что разрушать опухоль до последней клетки с помощью нагрева чревато осложнениями у пациента. А иммунного ответа, вызываемого апоптозом и легким перегревом в области опухоли, недостаточно, чтобы организм смог справиться с заболеванием самостоятельно. Поэтому совмещение разных методов помогает достичь лучших результатов. Например, использование химиотерапии после фототермической терапии помогает, с одной стороны, уничтожить оставшиеся клетки опухоли, а с другой ― уменьшить дозы химиопрепаратов. К тому же использование разных механизмов воздействия уменьшает риск возникновения у раковых клеток устойчивости к тому или иному методу лечения.
«Наличие у золотых наночастиц высокого поглощения в области ближнего инфракрасного цвета делает их превосходным материалом для фототермической терапии. Существует большое количество статей, посвященных этому методу, а некоторые проекты даже доходили до клинических испытаний. Сейчас ранее разработанные подходы к лечению рака начинают комбинировать для достижения синергического эффекта — мы уже достаточно хорошо изучили их механизмы и знаем, как они работают. Фототермическая терапия постепенно уходит с фронтира и становится практическим медицинским методом. На мой взгляд, в ближайшие пять лет мы увидим ее в реальной клинической практике», — заключает Алексей Пельтек.

Алексей Пельтек. Фото: Дмитрий Григорьев / ITMO.NEWS
Статья: Oleksii O. Peltek, Eduard I. Ageev, Pavel M. Talianov, Alexander S. Timin, Mikhail V. Zyuzin, et al., Fluorescence-based thermometry for precise estimation of nanoparticle laser-induced heating in cancerous cells at nanoscale (Nanophotonics, 2022).
Евгений Шилинг
Последние новости
-
-
Ученые ИТМО, МФТИ и Сколтеха создали лазер-управляемую систему для перепрограммирования макрофагов внутри опухоли
-
В ИТМО создали оптическую платформу, которая переключает светодиоды за десять наносекунд
-
Российские ученые придумали простой способ определения параметров закрученных частиц в ускорителях
-
Исследование ученых Нового физтеха ИТМО вошло в топ-10 открытий, поддержанных РНФ
